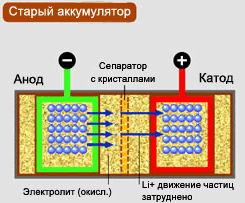
Литиевый аккумулятор состоит из отрицательно заряженного электрода, который называется анод, и положительно заряженного электрода, который называется катод.
Между анодом и катодом находится электролит. Ионы (заряжаемые атомы) проходят через электролит, чтобы создать в них энергию.
Катод обычно изготавливается из смешанных металлов, например оксид лития и кобальта или оксид литий - марганца. Какой бы из материалов не использовался, он должен давать возможность литий-ионам легко "перемещаться" внутри себя. Анод сделан из лития, который сдерживает такие материалы как графит и другие карбоновые материалы. Электролит изготовлен из материала, подобного катодам, чтобы дать возможность ионам свободно перемещаться.
В процессе зарядки батареи литий-ион из катода, имеющий металлическое строение, протекает через электролит в анод. Литий-ионы имеют положительный заряд. Во время движения Li-ions, электроны перейдут через сепаратор (с кристаллами) из анода в катод, но не через электролит. Электролит лишь позволяет ионам рассеиваться. Процесс зарядки/разрядки происходит посредством цикличного движения потоков ионов между электродами. В процессе повторяющегося окисления электрода, работа батареи, способность заряжаться и срок службы батареи прогрессивно снижается.
Зарядка элемента :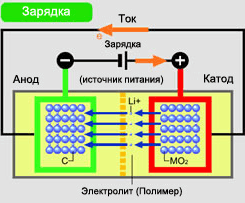
• Аккумулятор подключен к зарядному устройству.
• Положительно заряженный электрод (катод) окислен.
• Электроны протекают по внешней цепи к отрицательно заряженному электроду.
• Положительно заряженные ионы (Li+Ion) протекают через электролиты к отрицательно заряженным электродам.
• Электрическая цепь замкнута.
• Положительно заряженные ионы группируются в отрицательно заряженном электроде.
Разрядка элемента :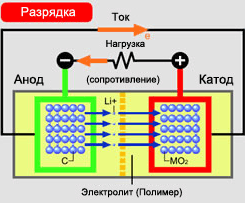
• Аккумулятор подключён к устройству, которое он питает.
• Отрицательно заряженный электрод (анод) окислен.
• Электроны перемещаются через сопротивление к положительно заряженному электроду.
• Положительно заряженные литий-ионы протекают через электролит в положительно заряженный электрод (катод).
• Электрическая цепь замкнута.
• Положительно заряженные ионы группируются в положительно заряженном электроде.
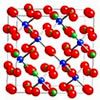
| Атомарная структура внутри катода Li-Ion аккумулятора | |
 |
 |
|
Полностью заряжен
Mn2O4 - окислен |
Полностью разряжен
Li1Mn2O4 - Mn истощён |

Cепаратор, металл, состоящий из нескольких составляющих, ответственен за такое кристаллическое образование, образующее кристаллы с острыми углами, которые могут повредить (проткнуть) сепаратор, что ведет к ускорению саморазряда или даже к короткому замыканию. Кристаллы растут на всей рабочей поверхности сепаратора. Результатом является снижение напряжения, что ведет к потере ёмкости. На поздних стадиях, острые углы кристаллов могут "прорасти" через сепаратор, ведя за собой скорую саморазрядку и короткое замыкание.
Поток ионов больше не перемещается как положено, таким образом просто сокращая «жизнь» аккумулятора.

Теплота, возникающая при зарядке-разрядке, перемещении и аккумуляции ионов в электроде, является причиной механического изменения объема (увеличения + уменьшения) приблизительно на 7-9 % от общего объема. Механические изменения составляющих аккумулятора при его нагреве вызывают частичное разбиение электродов и металлических частиц внутри электролита. Эти частицы не могут больше ионизироваться для нормальной работы батареи и теряют способность к зарядке.